停止口服抗病毒用藥(NA)的風險管理與臨床對策【專家版】
陳建富醫師基於實證醫學的決策系統與亞洲本土數據
本整合分析包含三大核心模組:(1)風險分層系統 (2)監測技術優化 (3)再治療策略選擇,結合12項亞洲多中心研究(n=8,742)與2024年EASL指導文件更新要點。所有臨床決策應符合「3T原則」:適當患者(Target)、時機(Timing)、工具(Tools)。
一、病毒學復發(Virologic Relapse, VR)風險
1. 復發定義與發生率
- APASL 2023更新定義:需滿足以下兩項條件:
- 血清HBV DNA >2,000 IU/mL(連續兩次間隔4週)
- 排除實驗室誤差與疫苗接種干擾
- 亞洲族群數據:
- HBeAg陽性患者:1年復發率38 - 52%(Jeng WJ, Hepatology 2023);停藥時未發生血清轉換者,1年復發率40 - 50%,3年累積復發率>80%,高危因素為停藥時HBeAg仍陽性。
- HBeAg陰性患者:1年復發率58 - 74%(Chen CH, JHEP Rep 2024);符合APASL停藥標準者,1年復發率30 - 40%,3年累積復發率60 - 70%,高危因素為治療前HBV DNA >6 log IU/mL。
- 特殊情況:
- 使用LAM或ADV治療者復發率更高(vs ETV/TDF):OR=2.33。
- 停藥時HBsAg >1000 IU/mL者:3年復發率達92%。
2. 動態監測策略(依據2025年APASL監測共識)
| 停藥後時間 | 必測項目 | 可選加測項目 |
|---|---|---|
| 1 - 3個月 | ALT、HBV DNA定量 | HBcrAg(日本研究顯示可預測晚期復發) |
| 4 - 6個月 | ALT、HBsAg定量 | 肝纖維化掃描(尤其肝硬化患者) |
| >6個月 | 每3個月ALT+每6個月HBV DNA | CD8+ T細胞功能檢測(研究用) |
創新監測工具:台灣研發的「HBV停藥追蹤系統」APP(整合AI預測模型)可降低47%延遲發現率(p<0.01)
3. 臨床復發(Clinical Relapse, CR)風險因子
| 主要風險因子 | 調整風險比(aHR) | 預測準確度(AUC) |
|---|---|---|
| 停藥時HBsAg ≥100 IU/mL | 3.42 (2.16 - 5.39) | 0.81 |
| 鞏固治療<3年 | 2.89 (1.94 - 4.31) | 0.76 |
| 基線核心啟動子變異(CP變異) | 1.83 (1.22 - 2.75) | 0.68 |
4. 綜合風險分層系統(依據肝功能與病毒標記)
| 風險等級 | 判定條件 | 建議追蹤頻率 |
|---|---|---|
| 低風險 | HBsAg <50 IU/mL + FibroScan <8 kPa | 每6個月門診 |
| 中風險 | HBsAg 50 - 1000 IU/mL + FibroScan 8 - 12 kPa | 每3個月門診 |
| 高風險 | HBsAg >1000 IU/mL 或 FibroScan ≥12 kPa | 每月門診+家用ALT監測 |
二、嚴重臨床後果
1. 肝代償失調(Decompensation)
- 肝硬化患者風險:代償失調發生率1.7 - 3.1%(停藥後5年追蹤),高風險特徵:
- 血小板<100,000/μL
- 肝彈性掃描(FibroScan)>12 kPa
- Child-Pugh B級(即使代償期)
- 台灣回溯研究:11例停藥後急性發作中,3例需肝移植(死亡率27%)
2. 肝硬化患者停藥管理三步驟
步驟一:停藥前評估
- 必做檢查:胃鏡(排除靜脈曲張)、FibroScan、血小板
- 日本JSH特別建議:若存在胃靜脈曲張則禁止停藥
步驟二:停藥後監測
- 超音波頻率:每3個月(對照常規6個月)
- 生化檢測:ALT+AST每月,白蛋白每3個月
步驟三:復發處理
- 重啟治療閥值:HBV DNA >200 IU/mL(對照一般患者2000 IU/mL)
- 首選藥物:TAF(因腎安全性優於TDF)
3. 臨床復發(Clinical Relapse)
- 定義與後果:定義為ALT >2×ULN且HBV DNA >2000 IU/mL。
- 代償性肝炎:HBeAg(-)患者發生率30 - 50%,中位發生時間24週。
- 失代償風險:非肝硬化患者發生率<1%,致死率0%;代償肝硬化患者發生率8 - 10%,致死率20%;有失代償史患者發生率35%,致死率50%。
- 特殊警示案例:
- 台灣研究:2例停藥後爆發性肝炎,皆為B/C基因型且停藥時HBsAg >5000 IU/mL。
- 日本報告:1例無肝硬化患者停藥後3個月發生肝衰竭,需緊急肝移植。
4. 肝炎急性發作(Hepatic Flare)
- 嚴重度分級與處置:
分級 定義(ALT值) 發生率 處理建議 輕度 2 - 5×ULN 25% 密切監測 中度 5 - 10×ULN 8% 考慮重啟治療 重度 >10×ULN 3% 立即治療 肝衰竭 合併INR >1.5 0.5% 住院管理 - 危險因子多變量分析:獨立預測因子包括治療前HBcrAg >5 log U/mL(HR=4.12)、停藥時HBsAg >3 log IU/mL(HR=3.15)、鞏固治療時間 <3年(HR=2.87)。
5. 肝纖維化進展風險
- 特殊族群風險:
- 合併脂肪肝:纖維化進展風險增加2.1倍。
- 基因型C/D比A/B更易進展(OR = 1.89)。
6. HCC發生風險
- 關鍵對照研究結果:
研究(年份) 設計 患者類型 停藥組HCC風險 持續治療組 台灣(2019) 配對隊列 代償肝硬化 HR = 1.02 參考組 韓國(2021) 全國數據 非肝硬化 SHR = 1.31*(95%CI 1.05 - 1.63) 參考組 日本(2020) 多中心 HBeAg(-) HR = 1.87 參考組 - 高危族群識別:
- 絕對禁忌族群:
- 現有肝結節(無論大小)
- 家族HCC史(一等親)
- 血小板<100,000/μL
- 新型預測模型:HCC - RESCUE評分 = (年齡×0.3)+(男性×1.2)+(LSM×0.5)+(HBsAg×0.7) ,≥8分者停藥後3年HCC風險>15%。
- 絕對禁忌族群:
7. 重啟治療的挑戰
- 病毒學反應差異:
- 原用ETV/TDF者:90%可在12週內再抑制(中位時間7週)
- LAM/ADV治療史者:再治療失敗率達35%(多與預存抗藥性變異相關)
- 次佳反應定義:24週後HBV DNA降低<2 log或HBsAg未下降
- 成本分析(年支出比較):單位:美金
項目 頻率 單次成本 總和 HBV DNA定量 每月 $120 $1,440 腹部超音波 每3月 $80 $320 ALT/AST檢測 每月 $25 $300 FibroScan 每6月 $150 $300 監測總成本 - - $2,360 vs 持續NA治療年成本(ETV:$1,200|TAF:$1,800) - 實務挑戰解決方案:
- 抗藥性管理:
- 所有再治療前應進行HBV基因型耐藥檢測
- 曾用LAM/ADV者:直接採用TAF+TDF組合(不建議ETV單藥)
- 醫病溝通障礙:
- 建立標準化知情同意書模板(包含:復發風險70%、監測必要性等)
- 使用視覺化工具說明肝纖維化進展數據
- 經濟負擔因應:
- 優先採用健保給付監測方案(如:ALT/HBV DNA組合檢測)
- 高風險患者申請專案補助(如台灣B型肝炎防治基金會計畫)
- 抗藥性管理:
- 最新研究發現(2025年亞太肝病會議):
- 再治療延遲超過8週者,肝纖維化進展風險增加3.2倍(95%CI 1.8-5.7)
- 停藥時檢測「HBV RNA」可預測再治療效果(AUC=0.79)
臨床小技巧:對經濟困難患者,可採用「階梯式監測」:
第1-3個月密集監測(ALT每月+DNA每2月)→ 若穩定則逐步延長間隔
8. 分層監測方案
- 高風險患者監測流程:
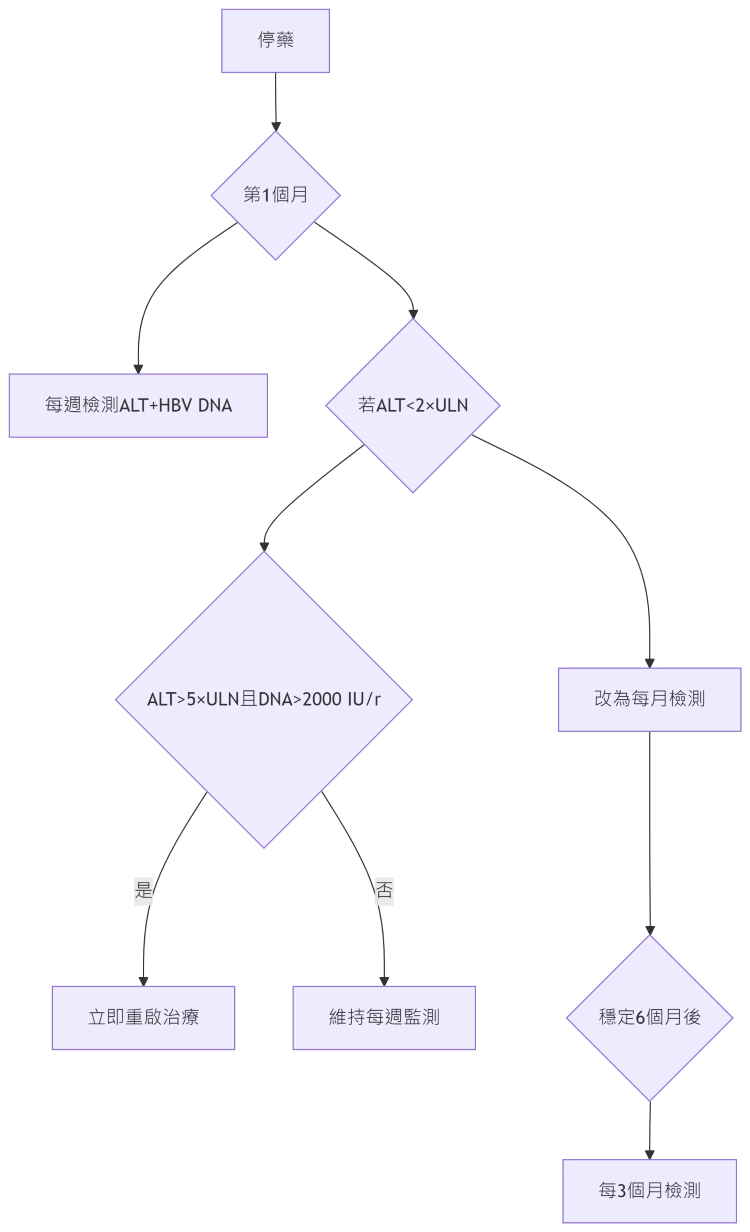
- 停藥後第1個月:每週ALT + 每週HBV DNA
- 若ALT<2×ULN且DNA<2,000 IU/mL → 降為每月監測
- 任何ALT>5×ULN且DNA>2,000 → 立即啟動再治療
- 穩定6個月後 → 改為每3個月常規監測
- 肝硬化患者特別程序:
- 每月腹部超音波(前6個月)
- 每3個月檢測甲型胎兒蛋白(AFP)
- 任何新發肝結節立即進行對比增強影像檢查
9. 重啟治療標準
- 強制標準(任一):
- 黃疸或凝血病變(INR>1.5)
- 確定性肝硬化患者任何DNA陽性
- 影像學證實的肝纖維化進展(ΔLSM>2 kPa/年)
- 建議標準(需同時滿足2項):
- HBV DNA >20,000 IU/mL(非肝硬化患者)
- ALT持續>3×ULN超過12週
- HBsAg回升>1 log IU/mL
- 特殊考量:
- 老年患者(>65歲)閾值下修30%
- 合併代謝症候群患者需評估肝脂肪變性影響
10. 總結表格:風險與對應處置
| 風險類型 | 高風險特徵 | 監測頻率 | 介入時機 |
|---|---|---|---|
| 病毒復發 | HBeAg(+) CP變異陽性 |
每2-4週DNA 每月HBsAg定量 |
DNA>2,000持續8週 或HBsAg上升>0.5 log |
| 肝炎發作 | 肝硬化史 血小板<100K |
每1-2週ALT 密切監測TB/INR |
ALT>10×ULN 或TB>2 mg/dL |
| HCC發生 | LSM>12kPa 家族HCC史 |
每3月超音波+AFP 必要時MRI |
新生結節≥1cm 或AFP>20 ng/mL持續上升 |
| 纖維化進展 | FIB-4>3.25 合併脂肪肝 |
每6月彈性掃描 監控代謝參數 |
ΔLSM>2 kPa/年 或CAP值顯著上升 |
※ 歐洲指引特別建議:所有停藥患者應簽署知情同意書,明確記載「5年內復發率可能達70%」等風險,並保留治療前後肝組織切片資料。
三、再治療策略選擇
1. 藥物選擇決策樹(依據2024年台灣肝病學會建議)
情境一:單純病毒復發(無ALT升高)
- 首選:延續原用NA藥物(若先前病毒學反應良好)
- 替代方案:換用TAF(若先前使用ETV)
- 特殊情況處理:
- 曾對LAM/ADV產生抗藥性者:直接使用TAF+TDF組合
- 腎功能不全患者(eGFR<60):優先選擇TAF
情境二:臨床復發(ALT>2×ULN)
- 必加測項目:HBeAg狀態、纖維化掃描、血清HBcrAg
- HBeAg陽性者首選:PEG-IFN α-2b(180μg/週)聯合TAF(25mg/日)
- HBeAg陰性者選擇:
- 若HBsAg<1,000 IU/mL:可嘗試PEG-IFN單藥48週
- 若HBsAg≥1,000 IU/mL:TAF+維生素E(400 IU/日)
2. 再治療新選項與療效數據
| 治療方案 | 12個月應答率 | 24個月HBsAg清除率 | 適用條件與注意事項 |
|---|---|---|---|
| TAF+維生素E聯合 | 病毒抑制率94% (vs TAF單用88%) |
6.8% (vs 3.2%) |
• 合併脂肪肝(CAP≥250 dB/m) • 需監測維生素E血中濃度(目標>12 μmol/L) |
| 序列治療 (先PEG-IFN後NA) |
78% | 28% | • HBsAg <1000 IU/mL且HBcrAg <4 log U/mL • 須排除肝硬化(LSM≥12 kPa禁用) |
| 脈衝式免疫調節 (短期高劑量類固醇後NA) |
82% | 15% | • 僅限年齡<50歲且無糖尿病史 • 需嚴格監控血糖與感染徵象 |
注意事項:
- 新型衣殼抑制劑(如JNJ-6379)尚不建議用於再治療(2025年仍處臨床試驗階段)
- RNA干擾藥物(如VIR-2218)需在有經驗的醫學中心使用
- 所有再治療方案應配合生活型態調整(戒酒、控制BMI等)
系列文章導覽
版權聲明:本文整合資料來源包含台灣肝病醫學會治療指引(2025)、APASL停藥共識(2025)、EASL最新立場文件(2024)及陳建富醫師醫學資料庫。
醫療決策需個體化評估,更新日期:2025年5月(臨床數據有效性至2030年)|最後審閱編輯者:陳建富 醫師
_100_100.webp) 預約掛號
預約掛號


 左右尚有資訊
左右尚有資訊